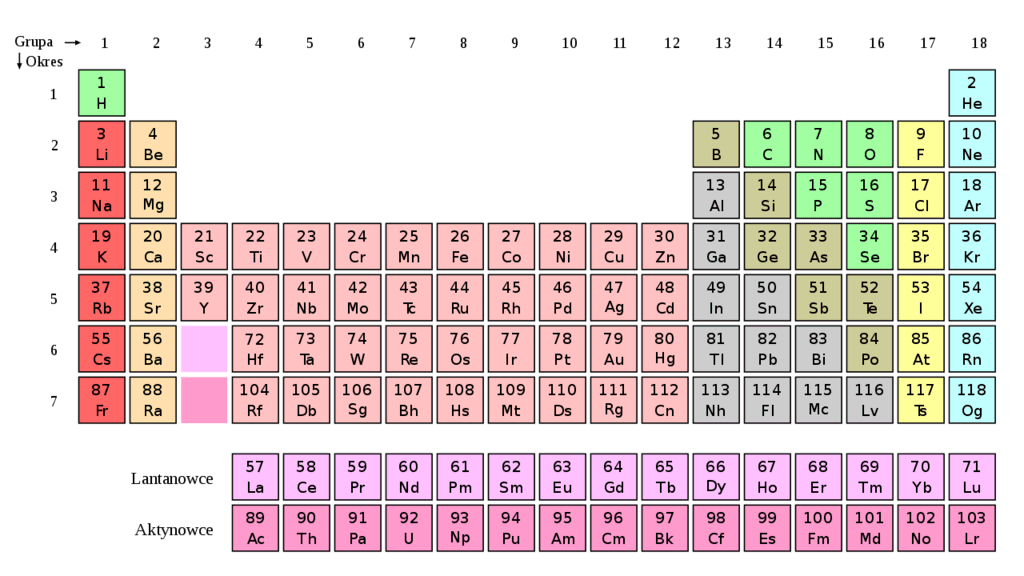الجدول الدوري لعناصر المواد الكميائية
ما هو الجدول الدوري؟
الجدول الدوري للعناصر أو ببساطة الجدول الدوري هو أداة رسومية يتم فيها سرد جميع العناصر الكيميائية المعروفة للبشرية ، منظمة وفقًا لعدد البروتونات من ذراتها ، وتسمى أيضًا العدد الذري ، وكذلك مع مراعاة التكوين من إلكتروناته والخصائص الكيميائية المحددة التي يمتلكونها.
وبهذه الطريقة ، فإن العناصر التي تتصرف بطريقة مماثلة تشغل الخطوط القريبة ، ويتم تحديدها في مجموعات (الأعمدة ، ثمانية عشر في الإجمالي) والنقاط (الصفوف ، سبعة في الإجمالي). من حيث المبدأ ، تتكون جميع المواد المعروفة في الكون من مجموعات مختلفة من العناصر الموجودة في هذا الجدول: 118 عنصرًا معروفة حتى الآن.
بالإضافة إلى ذلك ، يتم تمثيل عناصر الجدول الدوري برموزها الكيميائية الخاصة بها ، ومن خلال نظام الألوان الذي يشير إلى حالة تجمع العنصر عند درجة حرارة 0 درجة مئوية وضغط من 1 جو: أحمر (غازي) والأزرق (السائل) والأسود (الصلب) والرمادي (غير معروف).
الجدول الدوري هو أداة أساسية للكيمياء والبيولوجيا والعلوم الطبيعية الأخرى ، والتي يتم تحديثها على مر السنين ، حيث نتعلم المزيد عن أنماط المادة والعلاقات بين العناصر.
انظر أيضًا: باور كابس- علاج سحري للانفلونزا
انظر أيضًا: كورونا يغلق المؤسسات التعليميه بلبنان
تاريخ الجدول الدوري
تم نشر النسخة الأولى من الجدول الدوري في عام 1869 من قبل أستاذ الكيمياء الروسي دميتري مينديلييف ، وتضمنت 63 عنصرًا من 90 عنصرًا معروفًا اليوم في الطبيعة. في العام التالي ، نشر الألماني يوليوس لوثر ماير نسخة موسعة. نظم كلا الباحثين العناصر في صفوف ، بهدف ترك مساحات فارغة حيث شعروا أنه سيكون هناك عناصر لم يتم اكتشافها بعد.
في عام 1871 ، نشر Mendeléyev إصدارًا ثانيًا من الجدول الدوري ، حيث قام بتجميع العناصر وفقًا للسمات المشتركة في الأعمدة والمجموعات ، حيث يتم سرد العناصر الأولى من الأول إلى الثامن وفقًا لحالة الأكسدة للعنصر. ستأتي النسخة المعاصرة منه في يد Horace Groves Deming الأمريكية في عام 1923 ، مع 18 عمودًا محددًا بالفعل.
كيف يتم تنظيم الجدول الدوري؟
يتكون الجدول الدوري الحالي من سبعة صفوف (أفقية) تسمى فترات وفي 18 عمودًا (رأسيًا) تسمى مجموعات أو عائلات. يتم ترتيب العناصر الكيميائية وفقًا لخصائصها من اليسار إلى اليمين ومن أعلى إلى أسفل ، بترتيب تنازلي لأعدادها الذرية.
الهيدروجين (H). الهيليوم (He). الليثيوم (Li). البريليوم (Be). البورون (B). الكربون (C). النيتروجين (N). الأوكسجين (O). الفلورين (F). نيون (Ne). الصوديوم (Na ). المغنيسيوم (Mg). الألمنيوم (Al). السيليكون (Si). الفوسفور (P). الكلور (Cl). الكبريت (S). أرغون (Ar). البوتاسيوم (K). الكالسيوم (Ca). السكانديوم (Sc). التيتانيوم (Ti). الفاناديوم (V). الكروم (Cr). المنغنيز (Mn). الحديد (Fe ). الكوبالت (Co). النيكل (Ni). النحاس (Cu). الزنك (Zn). الغاليوم (Ga). جيرمانيوم (Ge). الزرنيخ (As). سيلينيوم (Se). البروم (Br). الكريبتون (Kr). الروبيديوم (Rb). سترونشيوم (Sr). الأتريوم(Y). زركونيوم (Zr). النيوبيوم (Nb). موليبدنوم (Mo). تكنيشيوم (Tc). الروثينيوم (Ru). الروديوم (Rh). بالاديوم (Pd). الفضة (Ag) كادميوم ( Cd). الإنديوم (In). القصدير (Sn). إثمد (Sb). تيلوريوم (Te). يود (I). زينون (Xe). سيزيوم (Cs). لانثانوم (Ba). سيريوم (La). السيريوم (Ce). براسوديميوم (Pr). نيوديميوم (Nd). بروميثيوم (Pm). ساماريوم (Sm). يوروبيوم (Eu). الغادولينيوم (Gd). التربيوم (Tb). ديسبروسيوم (Dy). هولميوم (Ho). إربيوم (Er). توليوم (Tm). إتيربيوم (Yb). لوتيشيوم (Lu). هافنيوم (Hf). تانتالوم (Ta). تنجستن (W). رينيوم (Re). أوزميوم (Os). إريديوم (Ir). بلاتين (Pt). ذهب (Au). الزئبق (Hg). ثاليوم (Ti). رصاص (Pb). بزموت (Bi). بولونيوم (Po). أستاتين (At). راديون (Rn). فرانسيوم (Fr). راديوم (Ra). أكتينيوم (Ac). ثوريوم (Th). بروتكتينيوم (Pa). يورانيوم (U). نبتونيوم (Np). بلوتونيوم (Pu). أمريسيوم (Am). كوريوم (Cm). بركيليوم (Bk). كاليفورنيوم (Cf). أينشتاينيوم (Es). فرميوم (Fm). مندليفيوم (Md). نوبليوم (No). لورنسيوم (Lr). رذرفورديوم (Rf). دوبنيوم (Db). سيبورغيوم (Sg). بوريوم (Bh). هاسيوم (Hs). مايتنريوم (Mt). دارمشتاتيوم (Ds). رونتيجينيوم (Rg). كوبرنيسيوم (Cn). نيهونيوم “أنون تريوم” (NH). فليروفيوم (Fl). موسكوفيوم (Mc). ليفرموريوم (LV ). تينيسين (TS). أوغانيسون (og).
وفرة العناصر الكيميائية
يوجد حاليًا 118 عنصرًا كيميائيًا معروفًا ، بين الطبيعي والاصطناعي. تميل الأولى إلى أن تكون في حالة نقية (مثل الهليوم في الغلاف الجوي) أو تشكل مركبات كيميائية (مثل الحديد ، نادرًا ما تكون في حالة نقية). سيعتمد ذلك على تفاعل العنصر وانجذاباته المميزة.
تعتبر العناصر الاصطناعية غير مستقرة إلى حد ما وعادة ما تطلق كميات من الطاقة والمادة (النشاط الإشعاعي) التي تشكل خطرا على الصحة. يمكن أن تستغرق عملية التحلل هذه كسورًا من الثانية ، كما هو الحال في oganeson (Og) ، أو يمكن أن تستغرق مئات وحتى ملايين السنين ، كما هو الحال في البلوتونيوم (Pu).
تم إنشاء الجدول الدوري للعناصر بواسطة Dmitri Mendeléyev في عام 1869 ، لطلب العناصر الكيميائية المعروفة بصريًا بناءً على خصائصها وخصائصها.
في الوقت الحاضر ، بعد العديد من التحديثات والتعديلات ، نستخدم إصدارًا جديدًا تظهر فيه العناصر التي تم توليفها مؤخرًا والتي تعمل كأداة للدراسة الذرية للطبيعة.
تصنيف العناصر الكيميائية
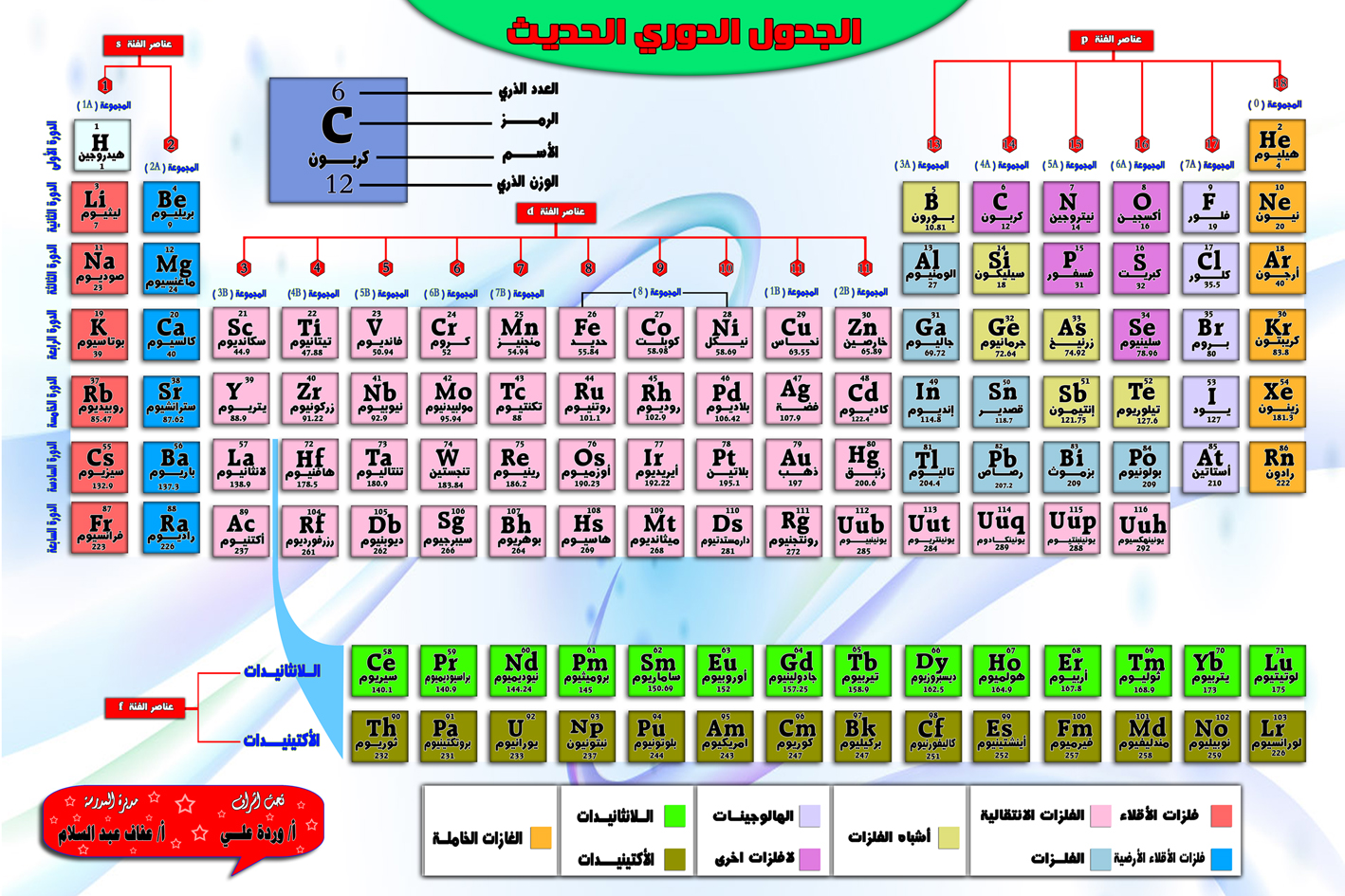
يمكن تصنيف العناصر الكيميائية بناءً على خصائصها ، كما يتم تمييزها وتنظيمها من خلال الجدول الدوري. بهذا المعنى ، نتحدث عن:
المعادن هذه العناصر الصلبة في درجة حرارة الغرفة (باستثناء الزئبق) ، وموصلات كثيفة وجيدة جدًا للحرارة والكهرباء. فهي مشرقة بشكل عام ، أي أنها تعكس الضوء. يتم تصنيفها بدورها إلى الأكتينيدات ، اللانثينيدات ، المعادن الانتقالية ، القلويات ، التراب القلوي والمعادن الأخرى.
لا معادن. هذه العناصر ليست موصلات جيدة للحرارة أو الكهرباء وهي ضعيفة جدًا بحيث لا يمكن تصفيحها أو تمددها كما هو الحال مع المعادن. معظمها ضروري للأنظمة البيولوجية (المركبات العضوية).
الفلزات. تصنيف متوسط بين المعادن واللافلزات ، يجمع بين خصائص المجموعتين. تعرف باسم شبه المعادن.
الهالوجينات. مجموعة من ستة عناصر تميل إلى تكوين جزيئات دياتومية نشطة كيميائياً للغاية ، بسبب سلبيتها الكهربية: عادة ما تشكل أيونات أحادية الأكسدة عالية (جزيئات مشحونة كهربائياً) ، لذلك عادة ما تكون هذه العناصر كاوية ومسببة للتآكل.
الغازات النبيلة. هذه المجموعة المكونة من سبعة عناصر تكون حالتها الطبيعية غازية ، بشكل عام تشكل جزيئات ثنائية الذرة ذات تفاعل منخفض للغاية وهذا هو السبب في أنها تعرف أيضًا بالغازات الخاملة. تشترك في معظم خصائصه الفيزيائية ومستقرة للغاية.
الرقم الذري هو مؤشر موجود في الجدول الدوري لعدد البروتونات الموجودة في نواة ذرات العنصر.
هذه المعلومات ذات أهمية قصوى في الكيمياء وفيزياء الكم: تذكر أن البروتونات مشحونة بشكل إيجابي وأن الإلكترونات مشحونة سلبًا ، لذا فإن العدد الذري يعمل على فهم (إلى جانب عدد الإلكترونات) سلوكها الكهرومغناطيسي.
كتلة الذرة تعادل عدد العناصر في نواتها: البروتونات والنيوترونات. اعتمادًا على ذلك ، ستكون ذرة أكثر كتلة أو أقل كتلة ويتم التعبير عنها في وحدات الكتلة الذرية (amu).
نظرًا لوجود نظائر ذات كتل ذرية مختلفة ، عادةً ما يتم حساب الكتلة الذرية للعنصر كمتوسط لجميع نظائرها المعروفة.